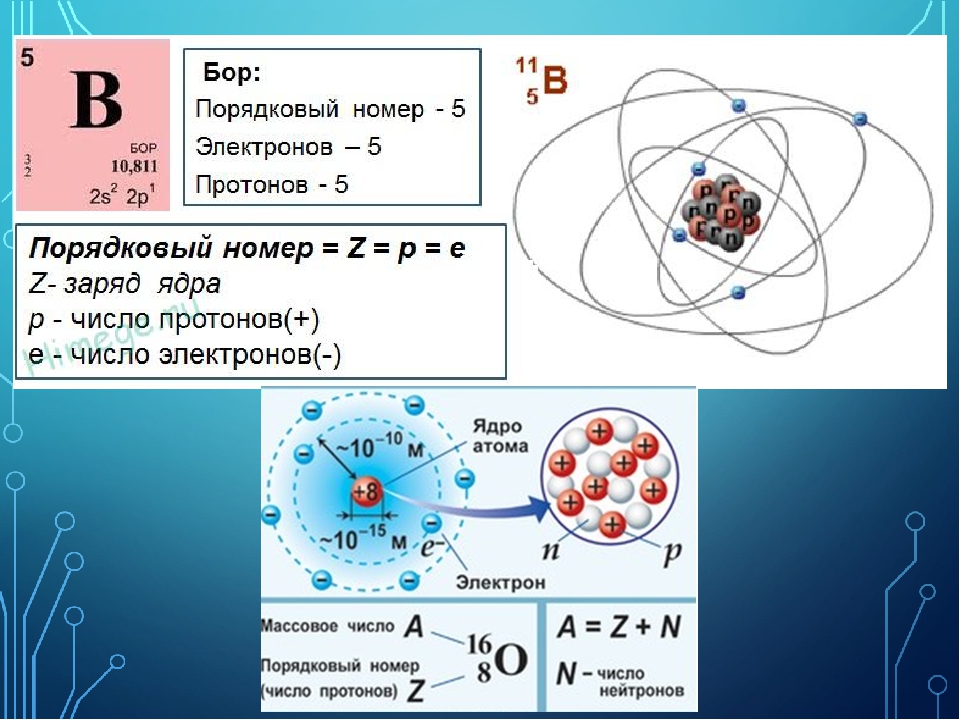
СОЛНЕЧНАЯ СИСТЕМА ИДЕНТИЧНАЯ АТОМУ БОРА
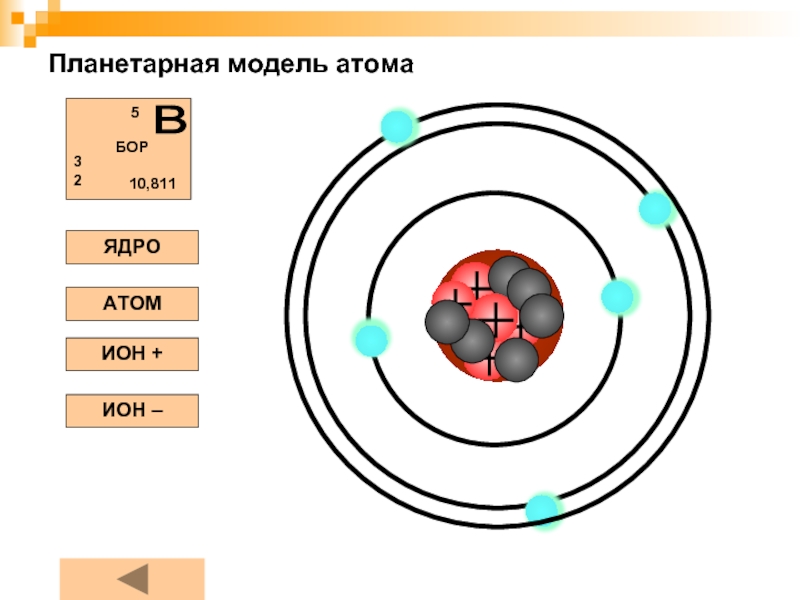
По нашему предположению СС идентична атому БОРА имеет 5 планет.
4 Земной группы и одна гигантов Юпитер.
Первая от Солнца идентична Меркурию
2-я Венере
3-я Земле
4-я Марсу
5-й Юпитер.
Таблица изотопов бора
Символ
нуклида Z(p) N(n) Масса изотопа
(а. е. м.) Период
полураспада[2]
(T1/2) Спин и чётность
ядра[2]
Энергия возбуждения
6B 5 1 6,04681
7B 5 2 7,02992 350 ис 3/2-
8B 5 3 8,0246072 770 мс 2+
9B 5 4 9,0133288 800 зс 3/2-
10B 5 5 10,0129370 стабилен 3+
11B 5 6 11,0093054 стабилен 3/2-
12B 5 7 12,0143521 20,20 мс 1+
13B 5 8 13,0177802 17,33 мс 3/2-
14B 5 9 14,025404 12,5 мс 2-
15B 5 10 15,031103 9,87 мс 3/2-
16B 5 11 16,03981 190 пс 0-
17B 5 12 17,04699 5,08 мс 3/2-
18B 5 13 18,05617 26 нс 4-
19B 5 14 19,06373 2,92 мс 3/2-
Заставить бор вступить в прямую реакцию с водородом практически невозможно. Бороводороды - обширный класс соединений, различных по составу и свойствам,- получают иначе. Традиционный путь - воздействие кислот на сплавы бора с магнием. При этом не только водород вытесняется из кислоты, но и образуются низшие бороводороды. Перечислим несколько их, наиболее известных: В2Н6, В4Н10, В5Н9, В10Н14. Очевидно, традиционные представления о валентности бора к этим соединениям неприменимы. Бороводороды химически нестойки, ядовиты, отличаются неприятным запахом. Но есть у них и несомненные достоинства. В частности, при сжигании бороводородов выделяется намного больше тепла, чем при сжигании обычных горючих.
Бороводороды легко вступают в химические реакции, превращаясь порой при этом в еще более своеобразные соединения. Так, при взаимодействии простейшего бо-роводорода B2H6 с гидридом алюминия АlН3 образуется самое летучее соединение алюминия - боранат Аl(ВН4)3.
Боранат считается перспективным реактивным топливом, как, впрочем, и некоторые другие производные бороводородов.ОБЩЕЕ КОЛИЧЕСТВО НЕЙТРОННЫХ ЗВЕЗД В ЯДРАХ ,ОБРАЗУЮЩИХ ОБЪЕМ СОЛНЦА И ЯДРАХ ПЛАНЕТ
В ЯДРАХ СОЛНЦА ПО ОДНОЙ НЕЙТРОННОЙ ЗВЕЗДЕ= 5
ПЛАНЕТАХ- 6
Всего одиннадцать. В-11.
пост в работе